

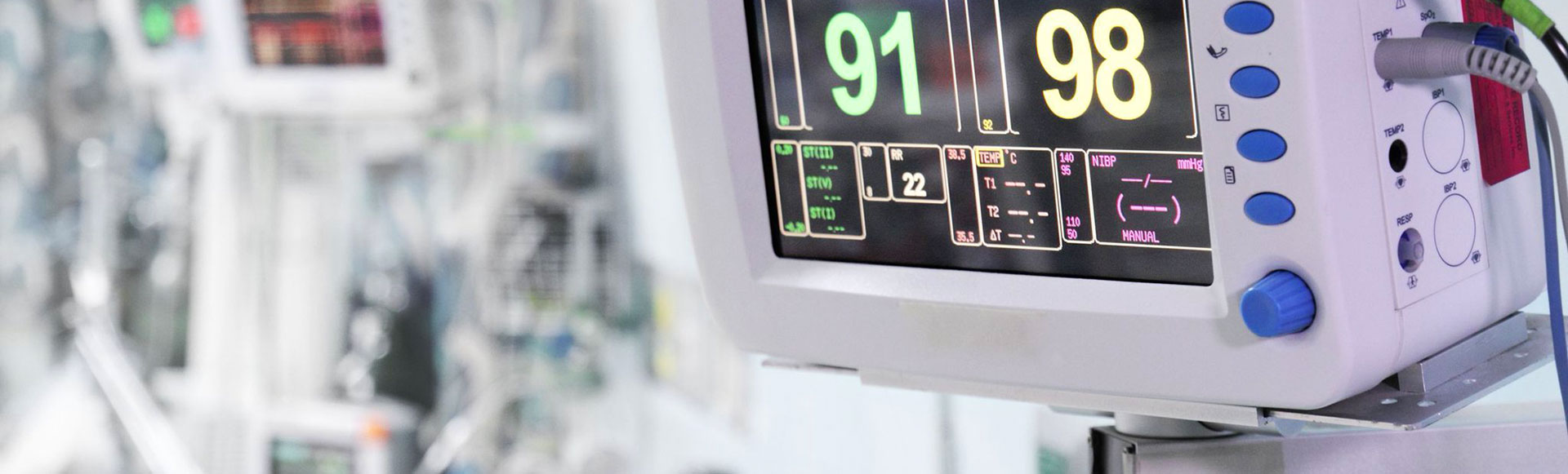
Le règlement légal 93/42/CEE publié dans les pays de l'Union européenne a une portée très large et son objectif est d'assurer la libre circulation des dispositifs médicaux sûrs au sein des pays de l'Union européenne. Dans le cadre de cette réglementation légale, tous les dispositifs doivent être sûrs pour les patients, les utilisateurs et les tiers et doivent atteindre le niveau de performance maximal attribué par les fabricants.
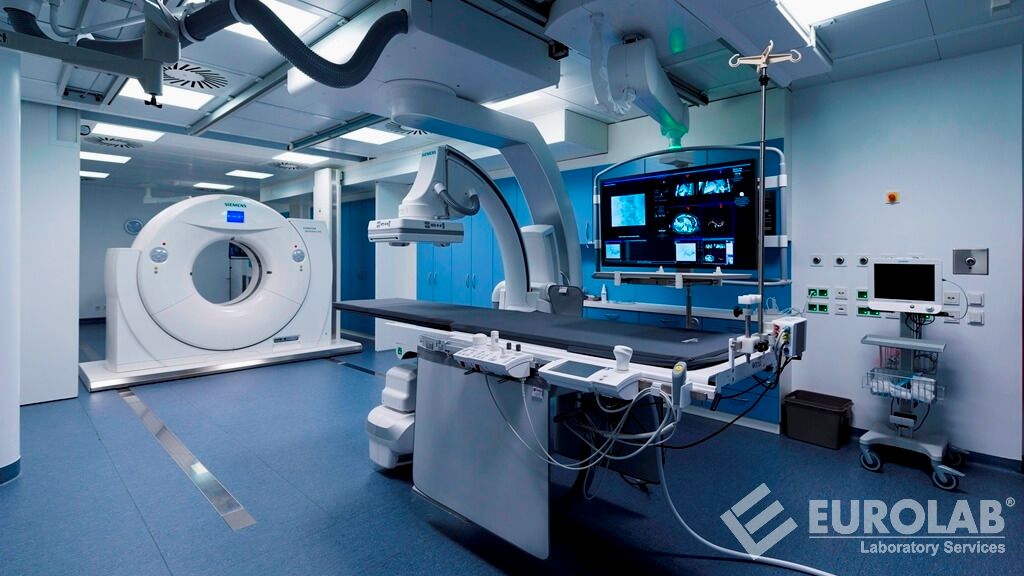
Ladite réglementation légale couvre les dispositifs médicaux utilisés pour le diagnostic, le suivi et le traitement des individus. Cette directive a été remplacée par la directive ultérieure 2017/745 (UE).
Les pays de l'Union européenne doivent prendre toutes les mesures nécessaires pour que les appareils ne soient mis sur le marché et mis en service que s'ils sont conformes aux exigences énoncées dans la présente directive, s'ils ont été dûment fournis et correctement installés, entretenus et utilisés conformément à leur utilisation prévue.
Les dispositifs médicaux sont classés selon ce règlement :
Avant qu'un fabricant n'entame la procédure nécessaire à l'évaluation de son produit, il doit décider si le produit en question doit faire l'objet d'une auto-évaluation ou si un organisme notifié doit être impliqué.
Les dispositifs médicaux regroupés en Classe I (dispositifs à faible risque) peuvent être évalués et déclarés par les fabricants en termes de sécurité et de conformité à la directive dispositifs médicaux. Toutefois, pour les dispositifs médicaux relevant des classes IIa, IIb et III (dispositifs à risque moyen et élevé), les fabricants sont tenus de faire appel à des organismes notifiés pour effectuer les procédures d'évaluation de la conformité nécessaires. Les organismes notifiés doivent déterminer et déclarer la conformité du produit aux exigences de la présente directive. En d'autres termes, l'organisme notifié doit participer à l'évaluation de ces dispositifs médicaux.
En bref, cette directive couvre tout dispositif médical remplissant les fonctions suivantes :
Notre organisation, avec son personnel formé et expert et ses équipements technologiques de pointe, parmi les nombreuses études de test, de mesure, d'analyse et d'évaluation qu'elle a réalisées pour des entreprises de divers secteurs, 93/42Elle fournit également des services de test et d'analyse dans le cadre de la directive sur les dispositifs médicaux numérotée /EEC.
