

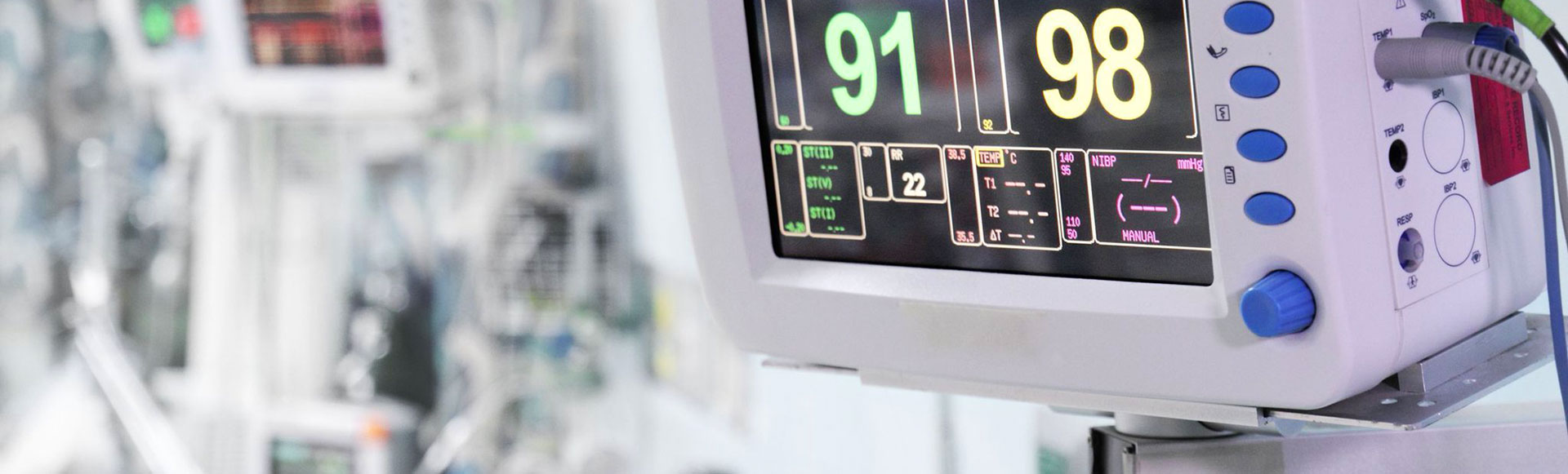
Regulacja prawna 93/42/EEC opublikowana w krajach Unii Europejskiej ma bardzo szeroki zakres i ma na celu zapewnienie swobodnego przepływu bezpiecznych wyrobów medycznych na terenie krajów Unii Europejskiej. W ramach tej regulacji prawnej wszystkie urządzenia muszą być bezpieczne dla pacjentów, użytkowników i osób trzecich oraz muszą osiągać maksymalny poziom wydajności przypisywany przez producentów.
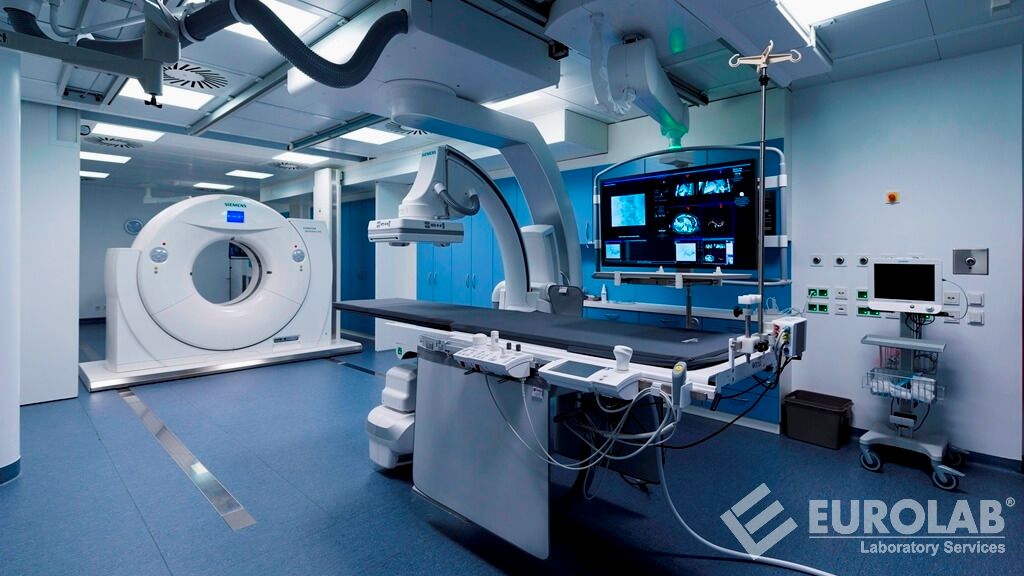
Wspomniana regulacja prawna obejmuje wyroby medyczne służące do diagnozowania, monitorowania i leczenia osób. Dyrektywa ta została zastąpiona późniejszą dyrektywą 2017/745 (UE).
Kraje Unii Europejskiej muszą podjąć wszelkie niezbędne kroki w celu zapewnienia, że urządzenia są wprowadzane na rynek i oddawane do użytku tylko wtedy, gdy spełniają wymagania określone w niniejszej dyrektywie, jeśli zostały należycie dostarczone i prawidłowo zainstalowane, konserwowane i używane zgodnie z ich przeznaczeniem.
Wyroby medyczne są klasyfikowane zgodnie z tym rozporządzeniem:
Zanim producent rozpocznie procedurę niezbędną do oceny swojego wyrobu, musi zdecydować, czy dany wyrób powinien podlegać samoocenie, czy też powinna być zaangażowana jednostka notyfikowana.
Wyroby medyczne zgrupowane w klasie I (wyroby niskiego ryzyka) mogą być oceniane i deklarowane przez producentów pod kątem bezpieczeństwa i zgodności z dyrektywą dotyczącą wyrobów medycznych. Jednak w przypadku wyrobów medycznych należących do klas IIa, IIb i III (wyrobów średniego i wysokiego ryzyka) producenci są zobowiązani do zaangażowania jednostek notyfikowanych do przeprowadzenia niezbędnych procedur oceny zgodności. Jednostki notyfikowane powinny określić i zadeklarować zgodność produktu z wymaganiami niniejszej dyrektywy. Innymi słowy, jednostka notyfikowana musi uczestniczyć w ocenie takich wyrobów medycznych.
W skrócie, niniejsza dyrektywa obejmuje wszelkie urządzenia medyczne, które spełniają następujące funkcje:
Nasza organizacja, z wyszkoloną i ekspercką kadrą oraz zaawansowanym wyposażeniem technologicznym, wśród licznych badań, badań, pomiarów, analiz i ocen, które zrealizowała dla firm z różnych sektorów, 93/42Świadczy również usługi testowania i analizy w zakresie dyrektywy dotyczącej wyrobów medycznych o numerze /EEC.
